PEI MAX 24765 - Transfection Grade Linear Polyethylenimine Hydrochloride (MW 40,000)
- 货号:
- 24765-100/24765-1
- 规格:
- 100mg/1g
- 目录价:
- ¥2126.00/14150.00
产品简介
PEI MAX——高产工业化转染试剂-高度浓缩,可制备大量转染试剂
Polysciences转染试剂系列是基于聚乙烯亚胺(Polyethylenimine,PEI)的产品,因其较高的转染效果,已广泛应用于工业化生产。聚乙烯亚胺是一种具有较高的阳离子电荷密度的有机大分子,每相隔二个碳原子,即每“第三个原子都是质子化的氨基氮原子,使得聚合物网络在任何pH下都能充当有效的“质子海绵”(proton sponge)体。PEI可用作转染试剂,它可以缩聚DNA分子形成颗粒并转染真核细胞。
PEI MAX 40K是由Polysciences出品的全合成线性聚乙烯亚胺瞬时转染试剂。PEI MAX是一款高度浓缩的粉剂,大量科学家选择PEI MAX ,在内部自行制备低成本高效益的PEI转染试剂。多年以来,经过众多业内人士评审的公开研究和出版文献表明,在HEK293、CHO 和 Sf9系统中可获得很高的转染效率,在重组抗体和病毒载体生产中稳定性高,可靠性强。PEI MAX 提供从96孔板到200L生物反应器持续的高基因表达细胞体系,实现从新药研发到工业化生产的轻松过度。而且与大多数细胞转染方案相比,使用PEI MAX 至少可降低40%转染成本(部分案例可降低90%转染成本)。
产品特点
PEI MAX 40K是线性聚乙烯亚胺盐酸盐形式(Linear Polyethylenimine Hydrochloride),是线性化聚乙烯亚胺PEI 25K的升级产品。相比于PEI 25K,PEI MAX 40K :
1.完全水解(去乙酰化);
2.盐酸盐形式,具更高的水溶特性;
3.含更长连续性乙烯亚胺片段,其质子化氮水平比PEI 25K提高11%以上。
应用领域
PEI MAX40K(cat#24765)是一款非GMP等级的PEI转染试剂,适用于基础学术研究和药物研发早期阶段,以固体粉末形式提供,需用户自行配置(详情见使用方法)。
客户体验
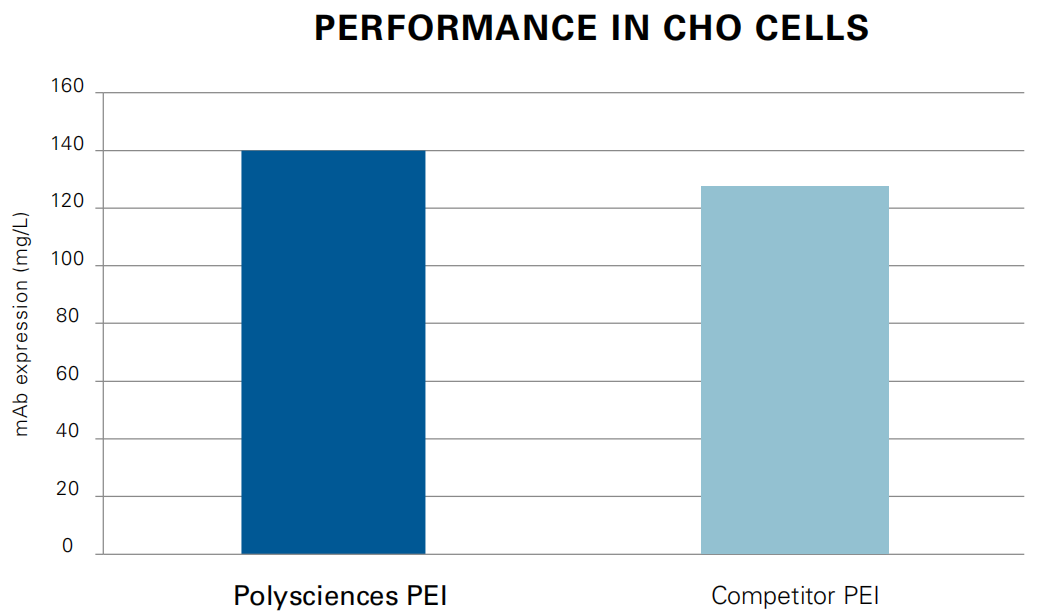
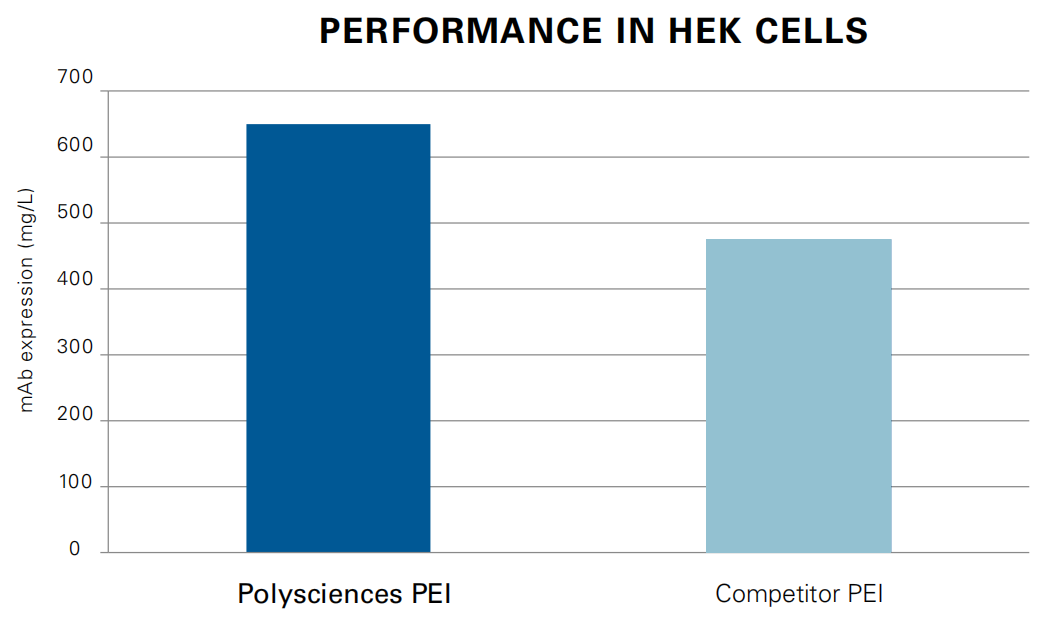
Expression of mAb B72-3, 8 days post-transfection using Gibco Freestyle F17 cell culture media . For more information, see the following publication: Delafosse, L., Xu, P. & Durocher, Y. Comparative study of polyethylenimines for transient gene expression in mammalian HEK293 and CHO cells. Journal of Biotechnology 227,103–111 (2016).
PEI MAX粉末配置方法:
1)将1g PEI MAX 40K放入盛有900 mL水的玻璃烧杯中;
2)放入搅拌转子,放置于磁力搅拌器上,设置搅拌程序以形成一个较小的漩涡;
3)等待PEI MAX 40K完全溶解,通常需要5分钟左右;
4)用25 mL塑料移液管加入1 N氢氧化钠滴定至pH 6.9~7.1;
5)如果不小心超过7.1,则使用1N的盐酸和新的塑料移液管将pH重新滴定至6.9~7.1;
6)将溶液转移到1L玻璃量筒中,加入水定容至1L;
7)用无菌真空过滤膜过滤配制的转染试剂溶液;
8)按需分装,4°C储存(切记不可冷冻);
注:未经配制的粉末有效期为2年。
配置成液体后分装在合适的瓶子中,并且保存在4℃的转染试剂将可在6个月之内保持性能。
如仅用于蛋白定性研究,分装的转染试剂可延长有效使用期至1年。
经过驯化的无血清培养悬浮细胞转染流程
1.准备工作
转染前 2~3 小时,种植细胞密度为 1X106 /mL 于培养容器中。
2. 转染步骤(以 250mL 摇瓶为例,转染前种植细胞总体积为 25mL,最终总培养体积为 50mL)
准备 PEI-DNA 转染混合物(以下操作顺序尤为关键)。
1)在含有2.5mL(25mL的10%)稀释液的聚丙烯EP管中加入 50ug 质粒 DNA(质粒用量建议在 1~2ug/106 细胞之间优化,此处使用 2ug/106 细胞);
2) 轻轻地混匀/振荡溶液;
3) 在 DNA 溶液中加入 50~200uL PEI 转染试剂(PEI/DNA 的比例建议在 1~4:1之间优化,首次推荐使用 2:1 或 3:1);
4) 涡旋振荡 5 秒钟;
5) 将管子静置于超净工作台 10~15 分钟,使 PEI-DNA 复合物形成(共孵育时间建议不超过 20 分钟);
6) 用移液器轻轻上下吹打混合液 3 次;
注:边晃动摇瓶,边将 PEI-DNA 混合液加入更换了培养基的转染孔中,确保 PEI-DNA 复合物均匀分布,防止局部浓度过高。
3. 孵育培养
将细胞培养瓶放入培养箱,摇瓶培养 2~3 小时后,加入25mL新鲜培养基,继续培养。
通常,在转染后36-48小时可检测到重组蛋白表达或包装的病毒颗粒。转染后72-96小时可观察到最大产量。
含血清培养的贴壁细胞转染流程
1. 准备工作
• 转染前18~24小时细胞铺板。
• 在培养基中加入合适数量的细胞,以确保在转染前形成 60~80%汇合度的单细胞层,此为最理想的细胞转染密度。
2. 转染步骤(以 6 孔板单孔举例)
• 转染前 1~2 小时,将需要转染的孔中的培养基替换成 3mL 新鲜的含有2%低血清或无血清的培养基。(高浓度血清抑制PEI的性能,大多数情况下,较低的血清含量(≤ 5%)或无血清将获得较高的转染效率)。
• 准备 PEI-DNA 转染混合物(以下操作顺序尤为关键)。
1) 在含有300uL(3mL的10%)稀释液的聚丙烯 EP 管中加入2ug质粒 DNA;
2) 轻轻地混匀/振荡溶液;
3) 在 DNA 溶液中加入 2~8 uL PEI 转染试剂(PEI-DNA 的比例建议在 1~4:1 之间优化,首次推荐使用 2:1 或 3:1);
4) 涡旋振荡 5 秒钟;
5) 将管子静置于超净工作台 10~15 分钟,使 PEI-DNA 复合物形成(建议共孵育时间不超过 20 分钟);
6) 用移液器轻轻上下吹打混合液 3 次
• 边晃动细胞培养板,边将 PEI-DNA 混合液加入更换了培养基的转染孔中,确保 PEI-DNA 复合物均匀分布,防止局部浓度过高。
3. 孵育培养
• 将细胞培养板放入培养箱培养 18~24(请注意,此处并非常规lipo脂质体转染的 4 小时后换液)小时后,更换含有血清的正常培养基;
• 通常,在转染后 36-48 小时可检测到重组蛋白表达或包装的病毒颗粒,转染后 72-96 小时可观察到最大产量。

